sábado, 5 de junio de 2010
viernes, 4 de junio de 2010
El modelo atómico de Rutherford era incapaz de explicar ciertos hechos:
* La carga negativa del electrón en movimiento iría perdiendo energía hasta caer contra el núcleo y esto haría que los átomos fuesen inestables.
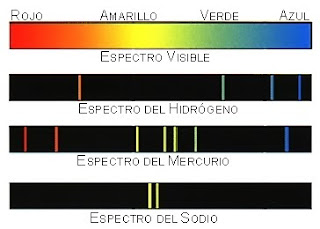
* Al hacer pasar radiación visible por un prisma, la luz se descompone en los colores del arco iris, esto se conoce como espectro continuo de la luz visible:
Pues bien, la luz que emiten los átomos de los elementos dan lugar a espectros discontínuos:
El hecho de que cada átomo tenga un espectro de rayas distinto y discontinuo debe estar relacionado con su estructura. Esto no se podía explicar con el modelo de Rutherford.
La masa de protones y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partículas subatómicas en el núcleo de los átomos.
Estas partículas fueron descubiertas en 1933 por J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
*Estructura del átomo:
Según esto, el átomo quedó constituido así:
*Isótopos:
A comienzos del siglo XX se descubrió que no todos los átomos de un mismo elemento tenían la misma masa. Es decir, el número de neutrones puede variar para átomos del mismo elemento.
Los isótopos son átomos de un mismo elemento que tienen igual número atómico, pero distintos números másicos. Es decir, tienen el mismo número de protones pero distinto número de neutrones.
Ejemplo: El elemento hidrógeno, cuyo número atómico es 1 (es decir, que posee un protón en el núcleo), tiene 3 isótopos en cuyos núcleos existen 0, 1 y 2 neutrones, respectivamente.
1. Determine la configuración electrónica de los siguientes iones:
a. Li+
b. O-2
c. Al+3
d. Cl-
e. Ca+2
2. Ordene de mayor a menor según sus primeros potenciales de ionización a los siguientes átomos:
a. Be, C, Ca y Rb
b. Mg, Cl, F y Sr
c. Na, Si, S, y O
d. Li, K, N y Ne
e. Ba, Be, O y F
3. Ordene de mayor a menor según sus radios covalentes a los siguientes átomos:
a. Be, B, K y Ca
b. F, Al, P y Cl
c. C, Mg, Si y Sr
d. N, O, Na y Al
e. F, K, Ca y Br
4. Ordene de mayor a menor según sus radios iónicos a los siguientes iones:
a. Na+1, Mg+2 , F-1 y Cl-1
b. Li+1, Be+2, O-2 y S-2
c. Na+1, S-2, Cl-1 y K+1
5. Ordene de mayor a menor según sus electronegatividades a los siguientes átomos:
a. N, Na, Al y P
b. Be, C, O y Mg
c. F, Si, Cl y K
6. Indica cuántos electrones hay en el último nivel de energía de cada uno de los siguientes átomos: Al, Na, I, Pb, Ca, C, N, Ne.