sábado, 5 de junio de 2010
viernes, 4 de junio de 2010
El modelo atómico de Rutherford era incapaz de explicar ciertos hechos:
* La carga negativa del electrón en movimiento iría perdiendo energía hasta caer contra el núcleo y esto haría que los átomos fuesen inestables.
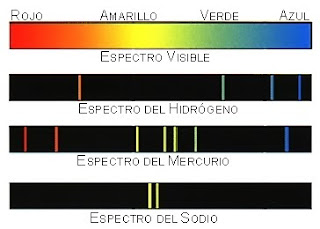
* Al hacer pasar radiación visible por un prisma, la luz se descompone en los colores del arco iris, esto se conoce como espectro continuo de la luz visible:
Pues bien, la luz que emiten los átomos de los elementos dan lugar a espectros discontínuos:
El hecho de que cada átomo tenga un espectro de rayas distinto y discontinuo debe estar relacionado con su estructura. Esto no se podía explicar con el modelo de Rutherford.
La masa de protones y electrones no coincidía con la masa total del átomo; por tanto, Rutherford supuso que tenía que haber otro tipo de partículas subatómicas en el núcleo de los átomos.
Estas partículas fueron descubiertas en 1933 por J. Chadwick. Al no tener carga eléctrica recibieron el nombre de neutrones.
Los neutrones son partículas sin carga y de masa algo mayor que la masa de un protón.
*Estructura del átomo:
Según esto, el átomo quedó constituido así:
*Isótopos:
A comienzos del siglo XX se descubrió que no todos los átomos de un mismo elemento tenían la misma masa. Es decir, el número de neutrones puede variar para átomos del mismo elemento.
Los isótopos son átomos de un mismo elemento que tienen igual número atómico, pero distintos números másicos. Es decir, tienen el mismo número de protones pero distinto número de neutrones.
Ejemplo: El elemento hidrógeno, cuyo número atómico es 1 (es decir, que posee un protón en el núcleo), tiene 3 isótopos en cuyos núcleos existen 0, 1 y 2 neutrones, respectivamente.
1. Determine la configuración electrónica de los siguientes iones:
a. Li+
b. O-2
c. Al+3
d. Cl-
e. Ca+2
2. Ordene de mayor a menor según sus primeros potenciales de ionización a los siguientes átomos:
a. Be, C, Ca y Rb
b. Mg, Cl, F y Sr
c. Na, Si, S, y O
d. Li, K, N y Ne
e. Ba, Be, O y F
3. Ordene de mayor a menor según sus radios covalentes a los siguientes átomos:
a. Be, B, K y Ca
b. F, Al, P y Cl
c. C, Mg, Si y Sr
d. N, O, Na y Al
e. F, K, Ca y Br
4. Ordene de mayor a menor según sus radios iónicos a los siguientes iones:
a. Na+1, Mg+2 , F-1 y Cl-1
b. Li+1, Be+2, O-2 y S-2
c. Na+1, S-2, Cl-1 y K+1
5. Ordene de mayor a menor según sus electronegatividades a los siguientes átomos:
a. N, Na, Al y P
b. Be, C, O y Mg
c. F, Si, Cl y K
6. Indica cuántos electrones hay en el último nivel de energía de cada uno de los siguientes átomos: Al, Na, I, Pb, Ca, C, N, Ne.
miércoles, 2 de junio de 2010
martes, 1 de junio de 2010
MODELOS ATÓMICOS
 MODELOS ATÓMICOS
MODELOS ATÓMICOSEn Ciencia, un modelo intenta explicar una teoría mediante una comparación. Un modelo será tanto más perfecto cuanto más claramente explique los hechos experimentales. El modelo es válido mientras explica lo que ocurre en los experimentos; en el momento en que falla, hay que modificarlo.
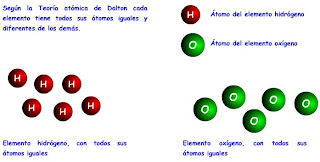
1.- Los elementos están formados por partículas diminutas, indivisibles e inalterables llamadas átomos.
Dalton estableció un sistema para designar a cada átomo de forma que se pudieran distinguir entre los distintos elementos:
3.- Los compuestos se forman por la unión de átomos de los correspondientes elementos según una relación numérica sencilla y constante.
* Un átomo es la partícula más pequeña de un elemento que conserva sus propiedades.
* Un elemento es una sustancia pura que está formada por átomos iguales.
* Un compuesto es una sustancia que está formada por átomos distintos combinados en una relación numérica sencilla y constante.
Este modelo permitía explicar varios fenómenos experimentales como la electrización y la formación de iones.
* La formación de iones: Un ion es un átomo que ha ganado o ha perdido electrones. Si gana electrones tiene carga neta negativa y se llama anión y si pierde electrones tiene carga neta positiva y se llama catión.





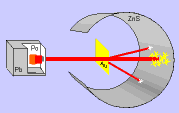
El modelo de Thomson tuvo una gran aceptación hasta que, en 1911, el químico y físico inglés Ernest Rutherford y sus colaboradores llevaron a cabo el "Experimento de Rutherford".
En el experimento se bombardeaba una fina lámina de oro con partículas alfa (positivas) procedentes de un material radiactivo y se observaba que:
- La mayor parte de las partículas alfa atravesaban la lámina sin cambiar de dirección, como era de esperar.
- Algunas partículas alfa se desviaron considerablemente.
- Unas pocas partículas alfa rebotaron hacia la fuente de emisión.
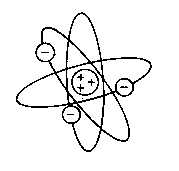
El Modelo atómico de Rutherford o modelo nuclear establece que:
* El átomo tiene un núcleo central en el que están concentradas la carga positiva y casi toda la masa.
* La carga positiva de los protones del núcleo se encuentra compensada por la carga negativa de los electrones, que están fuera del núcleo.
* El núcleo contiene, por tanto, protones en un número igual al de electrones del átomo.
* Los electrones giran a mucha velocidad alrededor del núcleo y están separados de éste por una gran distancia.
4. El modelo atómico de Bohr
Para solucionar los problemas planteados, el físico danés Niels Bohr formuló, en 1913, una hipótesis sobre la estructura atómica. Sus postulados eran:
1) El electrón sólo se mueve en unas órbitas circulares "permitidas" (estables) en las que no emite energía. El electrón tiene en cada órbita una determinada energía, que es tanto mayor cuanto más alejada esté la órbita del núcleo.
2) La emisión de energía se produce cuando un electrón salta desde un estado inicial de mayor energía hasta otro de menor energía.
* La distribución de electrones
Con el modelo atómico de Bohr sólo se podía explicar el espectro del átomo de hidrógeno. Hacia 1920 se introdujeron modificaciones y se desarrollaron nuevos modelos atómicos.
De acuerdo con este nuevo modelo, alrededor del núcleo hay capas o niveles de energía:
- En la primera capa se sitúan, como máximo, 2 electrones.
- En la segunda capa se sitúan, como máximo, 8 electrones.
- En la tercera capa se sitúan, como máximo, 18 electrones.
...
La distribución por capas de los electrones de un átomo de un elemento se conoce como estructura o configuración electrónica del elemento.
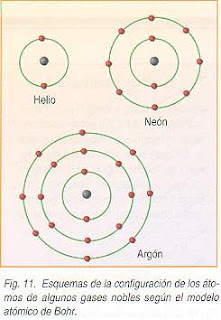
Ejemplos:
2He Tiene sólo 2 electrones. Se sitúan en la primera capa. Se representa como (2).
Las capas se colocan entre paréntesis y se separan por comas.
10Ne -> (2,8)
18Ar -> (2,8,8)
11Na -> (2,8,1)
15P -> (2,8,5)
A los electrones que están situados en la última capa se les denomina electrones de valencia y, al nivel que ocupan, capa de valencia. Estos electrones son los responsables de las propiedades químicas de las sustancias.
5. El modelo atómico de Schorödinger
En el modelo de Schrödinger se abandona la concepción de los electrones como esferas diminutas con carga que giran en torno al núcleo.
Schrödinger describe a los electrones por medio de una función de onda, el cuadrado de la cual representa la probabilidad de presencia en una región delimitada del espacio. Esta zona de probabilidad se conoce como orbital.
viernes, 14 de mayo de 2010
*Electrización por frotamiento
Campanitas de Franklin
Sombrero electrostático
Pequeños conductores unidos a una superficie conductora colocada sobre la esfera mayor del generador de Van der Graff, son repelidos quedando dispuestos en forma radial.
Una vez aceptada la teoría atómica de la materia, los fenómenos de electrización y electrólisis pusieron de manifiesto, por un lado, la naturaleza eléctrica de la materia y, por otro, que el átomo era divisible; es decir, que estaba formado por otras partículas fundamentales más pequeñas.
A finales del siglo XIX y principios del XX, una serie de experimentos permitieron identificar las partículas responsables de la carga negativa (el electrón) y de la carga positiva (el protón). Estos experimentos proporcionaron los datos siguientes sobre la estructura de la materia:
- El átomo contiene partículas materiales subatómicas.
- Los electrones tienen carga eléctrica negativa y masa. Cada electrón posee una carga eléctrica elemental.
- Los protones tienen carga eléctrica positiva y mayor masa.
- Como el átomo es eléctricamente neutro, hay que suponer que el número de cargas eléctricas negativas (electrones) es igual al número de cargas positivas (protones).
Los filósofos griegos discutieron mucho acerca de la naturaleza de la materia y concluyeron que el mundo era más simple de lo que parecía. Algunas de sus ideas de mayor relevancia fueron: